Интенсивная терапия
Инструкция по медицинскому применению лекарственного препарата Превимис
Инструкция по медицинскому применению лекарственного препарата
5332
Общая характеристика лекарственного препарата
▼ Данный лекарственный препарат подлежит дополнительному мониторингу. Это позволит быстро выявить новую информацию по безопасности. Мы обращаемся к работникам системы здравоохранения с просьбой сообщать о любых подозреваемых нежелательных реакциях. Порядок сообщения о нежелательных реакциях представлен в разделе 4.8.1. Наименование лекарственного препарата
Превимис, 240 мг, таблетки, покрытые пленочной оболочкой
Превимис, 480 мг, таблетки, покрытые пленочной оболочкой
2. Качественный и количественный состав
Действующее вещество: летермовир.Превимис, 240 мг, таблетки, покрытые пленочной оболочкой
Каждая таблетка, покрытая пленочной оболочкой, содержит 240 мг летермовира.
Вспомогательные вещества, наличие которых надо учитывать в составе лекарственного препарата: лактозы моногидрат – 4 мг (см. раздел 4.4).
Превимис, 480, мг таблетки, покрытые пленочной оболочкой
Каждая таблетка, покрытая пленочной оболочкой, содержит 480 мг летермовира.
Вспомогательные вещества, наличие которых надо учитывать в составе лекарственного препарата: лактозы моногидрат – 6,4 мг (см. раздел 4.4).
Полный перечень вспомогательных веществ приведен в разделе 6.1.
3. Лекарственная форма
Таблетки, покрытые пленочной оболочкой.Превимис, 240 мг, таблетки, покрытые пленочной оболочкой
Овальные двояковыпуклые таблетки, покрытые пленочной оболочкой желтого цвета, с тиснением «591» на одной стороне таблетки и логотипом компании «МСД» на другой стороне.
Превимис, 480, мг таблетки, покрытые пленочной оболочкой
Овальные двояковыпуклые таблетки, покрытые пленочной оболочкой розового цвета, с тиснением «595» на одной стороне таблетки и логотипом компании «МСД» на другой стороне.
4.Клинические данные
4.1. Показания к применению
Препарат Превимис показан к применению у взрослых для профилактики реактивации цитомегаловирусной (ЦМВ) инфекции и ЦМВ-ассоциированных заболеваний у ЦМВ‑серопозитивных реципиентов [R+] после аллогенной трансплантации гемопоэтических стволовых клеток (ТГСК).
4.2. Режим дозирования и способ применения
Препарат Превимис должен назначаться врачом, имеющим опыт лечения пациентов после аллогенной трансплантации гемопоэтических стволовых клеток.
Режим дозирования
Рекомендуемая доза препарата Превимис – 480 мг (1 таблетка) 1 раз в сутки.
Профилактику препаратом Превимис следует начинать после ТГСК. Препарат Превимис можно назначать в день трансплантации, но не позже 28 дня после нее. Препарат Превимис можно назначать как до приживления трансплантата, так и после. Профилактика препаратом Превимис должна продолжаться в течение 100 дней после трансплантации.
Безопасность и эффективность применения летермовира длительностью более 100 дней в клинических исследованиях не изучалась. Профилактика летермовиром продолжительностью более 100 дней после трансплантации может принести пользу некоторым пациентам с высоким риском поздней реактивации ЦМВ (см. раздел 5.1), однако требует тщательной оценки соотношения «польза – риск». При назначении препарата Превимис следует учитывать официальные руководства по надлежащему применению противовирусных препаратов.
Коррекция дозы
При одновременном применении препарата Превимис с циклоспорином, дозу препарата Превимис следует уменьшить до 240 мг 1 раз в сутки (см. разделы 4.5 и 5.2).
- Если циклоспорин назначается после начала приема препарата Превимис, последующие дозы препарата Превимис следует уменьшить до 240 мг 1 раз в сутки.
- Если циклоспорин отменяется после начала приема препарата Превимис, последующие дозы препарата Превимис следует увеличить до 480 мг 1 раз в сутки.
- Если из-за высокого уровня циклоспорина в плазме крови его применение временно прекращается, коррекция дозы препарата Превимис не требуется.
Пропущенная доза
Пациенты должны быть предупреждены, что в случае пропуска дозы препарата Превимис, им следует принять ее как только они вспомнят об этом. Если они не вспомнят об этом до времени приема следующей дозы, им необходимо пропустить прием забытой дозы и вернуться к обычной схеме. Пациентам не следует удваивать дозу или принимать препарат в более высокой, чем было назначено, дозе.
Особые группы пациентов
Пациенты пожилого возраста
Коррекция дозы препарата Превимис у пациентов пожилого возраста не требуется (см. разделы 5.1 и 5.2).
Пациенты с нарушением функции печени
Коррекция дозы препарата Превимис при легкой (класс А по Чайлд-Пью) или средней (класс B по Чайлд-Пью) степени нарушения функции печени не требуется. Препарат Превимис не рекомендуется назначать пациентам с тяжелой степенью нарушения функции печени (класс С по Чайлд-Пью) (см. раздел 5.2).
Пациенты с нарушением функции печени и почек
Препарат Превимис не рекомендуется назначать пациентам со средней степенью нарушения функции печени в сочетании со средней или тяжелой степенью нарушения функции почек (см. раздел 5.2).
Пациенты с нарушением функции почек
Коррекция дозы препарата Превимис для пациентов с легкой, средней или тяжелой степенью нарушения функции почек не требуется. Рекомендации по дозированию у пациентов с терминальной стадией почечной недостаточности с диализом или без него отсутствуют; безопасность и эффективность применения данного препарата у таких пациентов не была установлена.
Дети
Безопасность и эффективность препарата Превимис у детей в возрасте до 18 лет не установлены. Данные отсутствуют.
Способ применения
Для приема внутрь.
Таблетку следует проглатывать целиком, при этом ее можно принимать вне зависимости от приема пищи. Таблетку не следует делить, измельчать или разжевывать.
4.3. Противопоказания
Гиперчувствительность к летермовиру или к любому из вспомогательных веществ, перечисленных в разделе 6.1.
Одновременное применение с пимозидом (см. разделы 4.4 и 4.5).
Одновременное применение с алкалоидами спорыньи (см. разделы 4.4 и 4.5).
Одновременное применение со зверобоем продырявленным (Hypericum perforatum) (см. раздел 4.5).
При комбинации летермовира с циклоспорином противопоказано одновременное применение дабигатрана, аторвастатина, симвастатина, розувастатина или питавастатина (см. раздел 4.5).
4.4. Особые указания и меры предосторожности при применении
Мониторинг ДНК ЦМВ
Безопасность и эффективность летермовира была установлена у пациентов с отрицательным результатом анализа на ДНК ЦМВ перед началом профилактики. Мониторинг ДНК ЦМВ проводился еженедельно до 14-й недели после трансплантации, затем раз в 2 недели до 24-й недели. В случаях определения клинически значимого уровня ДНК ЦМВ в крови или выявления ЦМВ-ассоциированного заболевания профилактика летермовиром прекращалась и назначалась превентивная терапия или стандартный курс лечения, соответственно. У пациентов, которым была начата профилактика летермовиром и у которых при этом исходный анализ на ДНК ЦМВ впоследствии оказался положительным, профилактику можно было продолжить, если не были достигнуты критерии начала превентивной терапии (см. раздел 5.1).
Риск развития нежелательных реакций или снижения терапевтического эффекта вследствие взаимодействий с лекарственными препаратами
Одновременное применение препарата Превимис и определенных лекарственных препаратов может приводить к известным или потенциально клинически значимым лекарственным взаимодействиям, некоторые из которых могут способствовать:
- развитию потенциально клинически значимых нежелательных реакций вследствие более высокой экспозиции одновременно применяемого лекарственного препарата или летермовира.
- значимому снижению концентраций одновременно применяемого лекарственного препарата в плазме крови, что может приводить к снижению его терапевтического эффекта.
Взаимодействие с другими лекарственными препаратами
Следует соблюдать осторожность при применении препарата Превимис одновременно с лекарственными препаратами, которые являются субстратами CYP3A с узким терапевтическим диапазоном (например, алфентанил, фентанил и хинидин), поскольку это может приводить к повышению концентраций субстратов CYP3A в плазме крови. Рекомендуется тщательный мониторинг и/или коррекция дозы лекарственных препаратов – субстратов CYP3A (см. раздел 4.5).
В первые 2 недели после начала и завершения приема летермовира (см. раздел 4.5), как правило, рекомендуется усиленный мониторинг уровней циклоспорина, такролимуса и сиролимуса в крови.
Летермовир является умеренным индуктором ферментов и транспортных белков. Индукция может обусловить снижение концентраций в плазме крови некоторых лекарственных препаратов, которые метаболизируются ферментами или транспортируются белками (см. раздел 4.5). В этой связи рекомендуется терапевтический лекарственный мониторинг вориконазола, а также следует избегать одновременного назначения дабигатрана из-за риска снижения его эффективности.
Летермовир может повышать концентрации в плазме крови тех лекарственных препаратов, которые транспортируются OATP1B1/3, в частности, многих статинов (см. раздел 4.5 и таблицу 1).
Вспомогательные вещества
Препарат Превимис содержит лактозы моногидрат. Пациентам с редко встречающейся наследственной непереносимостью галактозы, дефицитом лактазы лопарей или с глюкозо‑галактозной мальабсорбцией не следует принимать этот препарат.
4.5. Взаимодействие с другими лекарственными препаратами и другие формы взаимодействия
Общая информация о различиях в экспозиции для разных режимов лечения летермовиром
- Расчетная экспозиция летермовира в плазме крови зависит от используемого режима дозирования (см. таблицу в разделе 5.2). В связи с этим, клинические последствия лекарственных взаимодействий для летермовира будут зависеть от применения летермовира в комбинации с циклоспорином или без него.
- Применение летермовира в комбинации с циклоспорином может приводить к усилению действия и другим эффектам одновременно применяемых лекарственных препаратов по сравнению с применением летермовира без циклоспорина (см. таблицу 1).
Влияние других лекарственных препаратов на летермовир
Пути выведения летермовира in vivo включают экскрецию с желчью и глюкуронирование. Относительная значимость этих путей неизвестна. Оба пути выведения включают активный захват гепатоцитами с помощью транспортных белков печеночного захвата OATP1B1/3. После захвата глюкуронирование летермовира опосредуется UGT1A1 и 3. Летермовир также является объектом опосредованного P-gp и BCRP эффлюкса в печени и кишечнике (см. раздел 5.2).
Индукторы ферментов или транспортных белков, участвующие в метаболизме лекарственных средств
Не рекомендуется одновременное применение препарата Превимис (с циклоспорином или без него) с мощными и умеренными индукторами транспортных белков (например, P-gp) и/или с ферментами (например, UGTs), так как это может привести к субтерапевтической экспозиции летермовира (см. таблицу 1).
- Примерами мощных индукторов являются рифампицин, фенитоин, карбамазепин, зверобой продырявленный (Hypericum perforatum), рифабутин и фенобарбитал.
- Примерами умеренных индукторов являются тиоридазин, модафинил, ритонавир, лопинавир, эфавиренз и этравирин.
Одновременное применение рифампицина изначально приводит к клинически незначимому повышению концентрации летермовира в плазме крови (из-за ингибирования OATP1B1/3 и/или P-gp), при продолжении применения рифампицина происходит последующее клинически значимое снижение концентрации летермовира в плазме крови (из-за индукции Р-gp/UGT) (см. таблицу 1).
Дополнительное влияние других препаратов на летермовир при одновременном применении летермовира с циклоспорином
Ингибиторы OATP1B1 или 3
Одновременное применение препарата Превимис с лекарственными препаратами, являющимися ингибиторами транспортных белков OATP1B1/3, может привести к повышению концентраций летермовира в плазме крови. При одновременном применении препарата Превимис с циклоспорином (сильным ингибитором OATP1B1/3), рекомендуемая доза препарата Превимис составляет 240 мг 1 раз в сутки (см. таблицу 1 и разделы 4.2 и 5.2). Рекомендуется соблюдать осторожность при добавлении других ингибиторов OATP1B1/3 к летермовиру в комбинации с циклоспорином.
- Примерами ингибиторов OATP1B1 являются гемфиброзил, эритромицин, кларитромицин и ряд ингибиторов протеаз (атазанавир, симепревир).
Ингибиторы P-gp/BCRP
Результаты, полученные in vitro, показывают, что летермовир является субстратом P‑gp/BCRP. Изменения концентраций летермовира в плазме крови вследствие ингибирования P-gp/ВCRP итраконазолом не были клинически значимыми.
Влияние летермовира на другие лекарственные препараты
Лекарственные препараты, в основном элиминирующиеся путем метаболизма или на которые влияет активный транспорт
Летермовир является индуктором in vivo ферментов и транспортных белков. Следует ожидать индукцию за исключением случаев, когда определенный фермент или транспортный белок также ингибируется (см. ниже). Следовательно, летермовир потенциально может приводить к снижению экспозиции в плазме крови и возможно к снижению эффективности одновременно применяемых лекарственных препаратов, которые в основном выводятся путем метаболизма или активного транспорта.
Степень индукции зависит от того, применяется ли одновременно циклоспорин или нет. Полную индукцию можно ожидать через 10-14 дней лечения летермовиром.
In vitro летермовир является ингибитором CYP3A, CYP2C8, CYP2B6, BCRP, UGT1A1, OATP2B1 и OAT3 в значимых концентрациях in vivo. Имеются исследования in vivo по изучению суммарного эффекта на CYP3A4, P‑gp, OATP1B1/3 и дополнительно на CYP2C19. Суммарный эффект in vivo в отношении других перечисленных ферментов и транспортных белков неизвестен. Подробная информация представлена ниже.
Остается неизвестным, может ли летермовир влиять на экспозиции пиперациллина/тазобактама, амфотерицина B и микафунгина. Потенциальные взаимодействия между летермовиром и данными лекарственными препаратами не изучались. Существует теоретический риск снижения экспозиции вследствие индукции, но величина и, следовательно, клиническая значимость этого эффекта в настоящее время неизвестны.
Лекарственные препараты, метаболизируемые CYP3A
Летермовир является умеренным ингибитором CYP3A in vivo. Одновременное применение препарата Превимис с мидазоламом (субстрат CYP3A), который принимают перорально, приводит к повышению концентраций мидазолама в плазме крови в 2-3 раза. Одновременное применение препарата Превимис и субстратов CYP3A может приводить к клинически значимому повышению концентраций в плазме крови последних (см. разделы 4.3, 4.4 и 5.2).
- Примерами подобных лекарственных препаратов являются некоторые иммунодепрессанты (например, циклоспорин, такролимус, сиролимус), ингибиторы ГМГ-КоА редуктазы и амиодарон (см. таблицу 1). Противопоказано применять пимозид и алкалоиды спорыньи (см. раздел 4.3).
Величина ингибирующего влияния CYP3A зависит от того, применяется ли одновременно циклоспорин или нет.
Суммарный эффект ингибирования фермента может быть достигнут после 10-14 дня вследствие зависимости ингибирования от времени и одновременной индукции. Время, необходимое для достижения равновесного состояния определенного лекарственного препарата, подверженного влиянию, будет также оказывать влияние на время необходимое для достижения полного эффекта в отношении концентрации препарата в плазме крови. Для исчезновения ингибирующего эффекта требуется 10-14 дней после завершения лечения. Мониторинг рекомендован в первые 2 недели от начала и после прекращения приема летермовира (см. раздел 4.4).
Лекарственные препараты, транспортируемые OATP1B1/3
Летермовир является ингибитором транспортных белков OATP1B1/3. Применение препарата Превимис может приводить к клинически значимому повышению концентраций одновременно применяемых лекарственных препаратов, являющихся субстратами OATP1B1/3, в плазме крови.
- Примерами подобных лекарственных препаратов являются ингибиторы ГМГ-КоА редуктазы, фексофенадин, репаглинид и глибурид (см. таблицу 1).
При отмене циклоспорина во время лечения летермовиром с субстратом OATP1B1/3 это следует учитывать.
Лекарственные препараты, метаболизируемые CYP2C9 и/или CYP2C19
Одновременное применение препарата Превимис с вориконазолом (субстрат CYP2C19) приводит к значительному снижению концентраций вориконазола в плазме крови, что указывает на то, что летермовир является индуктором CYP2C19. CYP2C9 также, вероятно, подвергается индуцированию. Летермовир потенциально способен снижать экспозицию субстратов СYР2С9 и/или СYР2С19, что может быть причиной их субтерапевтических уровней.
- Примерами подобных лекарственных препаратов являются варфарин, вориконазол, диазепам, лансопразол, омепразол, эзомепразол, пантопразол, тилидин, толбутамид (см. таблицу 1).
Ожидается, что влияние будет менее выраженным у летермовира при пероральном применении без циклоспорина, чем у летермовира при пероральном применении с циклоспорином. Это необходимо учитывать при отмене циклоспорина во время лечения летермовиром с субстратом CYP2C9 или CYP2C19. Следует обратить внимание на общую информацию по индукции относительно временной динамики взаимодействия, приведенной выше.
Лекарственные препараты, метаболизируемые CYP2C8
Летермовир ингибирует CYP2C8 in vitro, но исходя из его потенциальной способности быть индуктором, может также индуцировать CYP2C8.
Суммарный эффект in vivo неизвестен.
- Примером лекарственного препарата, который элиминируется в основном CYP2C8, является репаглинид (см. таблицу 1). Не рекомендуется одновременное применение репаглинида и летермовира с циклоспорином или без него.
Лекарственные препараты, транспортируемые P‑gp в клетках эпителия кишечника
Летермовир является индуктором P‑gp в клетках эпителия кишечника. Применение препарата Превимис может приводить к клинически значимому снижению концентраций одновременно применяемых лекарственных препаратов в плазме крови, которые в значительной степени переносятся в клетках эпителия кишечника с помощью P‑gp, таких как дабигатран и софосбувир.
Лекарственные препараты, метаболизируемые CYP2B6, UGT1A1 или транспортируемые BCRP или OATP2B1
Летермовир является основным индуктором in vivo, но также наблюдалось, что он ингибирует CYP2B6, UGT1A1, BCRP и OATP2B1 in vitro. Суммарный эффект in vivo не известен. Следовательно, концентрации в плазме крови лекарственных препаратов, являющимися субстратами этих ферментов или транспортными белками, при одновременном применении с летермовиром, могут как увеличиваться, так и снижаться. Следует рассмотреть возможность дополнительного мониторинга. Обратитесь к инструкции по медицинскому применению данных лекарственных препаратов.
- Примером лекарственного препарата, метаболизируемого CYP2B6, является бупропион.
- Примерами лекарственных препаратов, метаболизируемых UGT1A1, являются ралтегравир и долутегравир.
- Примерами лекарственных препаратов, транспортируемых BCRP, являются розувастатин и сульфасалазин.
- Примером лекарственного препарата, транспортируемого OATP2B1, является целипролол.
Лекарственные препараты, транспортируемые почечными транспортными белками OAT3
Данные in vitro показывают, что летермовир является ингибитором OAT3; следовательно, летермовир может быть ингибитором OAT3 in vivo. Концентрации лекарственных препаратов, транспортируемых OAT3, могут увеличиваться в плазме крови.
- Примерами лекарственных препаратов, транспортируемых OAT3, являются ципрофлоксацин, тенофовир, имипенем и циластин.
Общая информация
Если дозы одновременно применяемых лекарственных препаратов были скорректированы из-за лечения препаратом Превимис, то рекомендуется повторная коррекция доз после завершения лечения препаратом Превимис. Коррекция дозы может также потребоваться при замене иммунодепрессанта.
В таблице 1 представлен перечень подтвержденных или потенциально клинически значимых взаимодействий с лекарственными препаратами. Описанные взаимодействия с лекарственными препаратами основаны на исследованиях, проведенных с препаратом Превимис, или представляют собой предполагаемые лекарственные взаимодействия, которые могут возникнуть при применении препарата Превимис (см. разделы 4.3, 4.4, 5.1 и 5.2).
Таблица 1. Взаимодействия и рекомендации по дозированию при применении других лекарственных препаратов.
Обратите внимание, что данная таблица не является всеобъемлющей, так как в ней представлены примеры клинически значимых взаимодействий. См. также общий текст о взаимодействиях с лекарственными препаратами выше.
Если не указано иное, исследования взаимодействий проводились с летермовиром для перорального введения без циклоспорина. Пожалуйста, обратите внимание, что потенциальная возможность взаимодействия и клинические последствия могут различаться в зависимости от того, назначается ли циклоспорин одновременно с летермовиром. При замене иммунодепрессанта рекомендация касательно одновременного применения должна быть пересмотрена. |
Одновременно применяемый лекарственный препарат |
Влияние на концентрацию† Среднее отношение (90% доверительный интервал) для AUC‡, Cmax§ (вероятный механизм действия) |
Рекомендации относительно одновременного применения с препаратом Превимис |
Антибиотики |
||
Нафциллин |
Взаимодействие не изучалось.
Ожидается: |
Нафциллин может снизить концентрацию летермовира в плазме крови. Одновременное применении препарата Превимис и нафциллина не рекомендуется. |
Противогрибковые средства |
||
Флуконазол |
↔ флуконазол |
Коррекция дозы не требуется. |
Итраконазол |
↔ итраконазол |
Коррекция дозы не требуется. |
Позаконазол¶ |
↔ позаконазол |
Коррекция дозы не требуется. |
Вориконазол¶ |
↓ вориконазол |
Если одновременное применение необходимо, рекомендуется проводить терапевтический лекарственный мониторинг (ТЛМ) вориконазола в первые 2 недели после начала или завершения применения летермовира, а также после замены иммунодепрессанта. |
Противотуберкулёзные средства |
||
Рифабутин |
Взаимодействие не изучалось. |
Рифабутин может снижать концентрацию летермовира в плазме крови. |
Рифампицин |
||
(600 мг однократно перорально) / летермовир (480 мг однократная доза перорально) |
↔ летермовир |
Рифампицин при многократном применении снижает концентрацию летермовира в плазме крови. Одновременное применение препарата Превимис и рифампицина не рекомендуется. |
(600 мг однократно внутривенно (в/в) / летермовир (480 мг однократно перорально) |
↔ летермовир |
|
(600 мг 1 раз в сутки перорально) / летермовир (480 мг 1 раз в сутки перорально) |
↓ летермовир |
|
(600 мг 1 раз в сутки перорально (24 ч после рифампицинаÞ)) / летермовир (480 мг 1 раз в сутки перорально) |
↓ летермовир
AUC 0,15 (0,13; 0,17) |
|
Антипсихотические средства |
||
Тиоридазин |
Взаимодействие не изучалось. |
Тиоридазин может снижать концентрацию летермовира в плазме крови. Одновременное применение препарата Превимис и тиоридазина не рекомендуется. |
Антагонисты рецепторов эндотелина |
||
Бозентан |
Взаимодействие не изучалось. |
Бозентан может снижать концентрацию летермовира в плазме крови. Одновременное применение препарата Превимис и бозентана не рекомендуется. |
Противовирусные средства |
||
Ацикловир¶ |
↔ ацикловир | Коррекция дозы не требуется. |
Растительные препараты |
||
Зверобой продырявленный (Hypericum perforatum) |
Взаимодействие не изучалось. |
Зверобой продырявленный может снижать концентрацию летермовира в плазме крови. |
Средства для лечения ВИЧ-инфекции |
||
Эфавиренз |
Взаимодействие не изучалось. |
Эфавиренз может снижать концентрацию летермовира в плазме крови. |
Этравирин, невирапин, ритонавир, лопинавир |
Взаимодействие не изучалось. |
Данные противовирусные средства могут снижать концентрацию летермовира в плазме крови. Одновременное применение препарата Превимис и данных противовирусных средств не рекомендуется. |
Ингибиторы ГМГ-КоА редуктазы |
||
Аторвастатин¶ (20 мг однократно) / летермовир (480 мг в сутки) |
↑ аторвастатин |
Необходимо тщательно отслеживать нежелательные реакции, связанные с применением статинов, например, миопатии. Доза аторвастатина не должна превышать 20 мг в сутки при одновременном применении с препаратом Превимисβ. Хотя данное взаимодействие не изучалось, ожидается, что при одновременном применении препарата Превимис с циклоспорином, степень повышения концентраций аторвастатина в плазме крови будет выше, чем на фоне приема препарата Превимис без циклоспорина. При одновременном применении препарата Превимис с циклоспорином, применение аторвастатина противопоказано. |
Симвастатин, |
Взаимодействие не изучалось. |
Летермовир может значительно увеличивать концентрации данных статинов в плазме крови. Их одновременное применение с препаратом Превимис не рекомендуется. При одновременном применении препарата Превимис с циклоспорином, применение данных статинов противопоказано. |
Флувастатин, |
Взаимодействие не изучалось. |
Летермовир может увеличивать концентрации статинов в плазме крови. |
Иммунодепрессанты |
||
Циклоспорин |
↑ циклоспорин |
При одновременном применении препарата Превимис с циклоспорином, доза препарата Превимис должна быть уменьшена до 240 мг 1 раз в сутки (см. разделы 4.2 и 5.1). |
Циклоспорин |
↑ летермовир |
|
Микофенолата мофетил |
↔микофеноловая кислота |
Коррекция дозы не требуется. |
Сиролимус¶ |
↑ сиролимус |
Во время лечения препаратом Превимис и при его отмене следует проводить частый мониторинг концентраций сиролимуса в цельной крови, при этом доза сиролимуса должна соответствующим образом корректироватьсяβ. При начале или прекращении одновременного применения циклоспорина с препаратом Превимис рекомендуется также проводить частый мониторинг концентраций сиролимуса.
|
Такролимус |
↑ такролимус |
При отмене препарата Превимис следует проводить частый мониторинг концентраций такролимуса в цельной крови во время лечения, при этом доза такролимуса должна соответствующим образом корректироватьсяβ. |
Такролимус |
↔ летермовир AUC 1,02 (0,97, 1,07) Cmax 0,92 (0,84, 1,00) | |
Пероральные контрацептивы |
||
Этинилэстрадиол (ЭЭ) |
↔ ЭЭ |
Коррекция дозы не требуется. |
Другие пероральные контрацептивы |
Риск ↓ гормональных контрацептивов |
Летермовир может снижать концентрации других пероральных гормональных контрацептивов в плазме крови, и как следствие оказывать влияние на их эффективность. |
Противодиабетические лекарственные препараты |
||
Репаглинид |
Взаимодействие не изучалось. |
Летермовир может увеличивать или снижать концентрации репаглинида в плазме крови.
(Суммарный эффект неизвестен). |
Глибурид |
Взаимодействие не изучалось. |
Летермовир может увеличивать концентрации глибурида в плазме крови. |
Противоэпилептические лекарственные препараты (см. также общий текст) |
||
Карбамазепин, |
Взаимодействие не изучалось. |
Карбамазепин или фенобарбитал может снижать концентрацию летермовира в плазме крови. |
Фенитоин |
Взаимодействие не изучалось. |
Фенитоин может снижать концентрации летермовира в плазме крови. |
Пероральные антикоагулянты |
||
Варфарин |
Взаимодействие не изучалось. |
Летермовир может снижать концентрации варфарина в плазме крови. |
Дабигатран |
Взаимодействие не изучалось. |
Летермовир может снижать |
Седативные средства |
||
Мидазолам |
↑ мидазолам |
Следует проводить тщательный клинический мониторинг на предмет угнетения дыхания и/или затянувшегося седативного состояния при одновременном применении препарата Превимис с мидазоламом. Следует рассмотреть коррекцию дозы мидазоламаβ. При пероральном применении мидазолама одновременно с летермовиром в рекомендуемой дозе (480 мг) повышение концентрации мидазолама в плазме крови может оказаться более выраженным, чем наблюдалось при одновременномприменении летермовира в изучаемой дозе (240 мг). |
Агонисты опиоидных рецепторов |
||
Примеры: алфентанил, фентанил |
Взаимодействие не изучалось. |
Во время одновременного применения рекомендуется частый мониторинг на наличие нежелательных реакций, связанных с данными лекарственными препаратами. Может потребоваться коррекция доз опиоидов, метаболизируемых CYP3A β (см. раздел 4.4). Если препарат Превимис применяется одновременно с циклоспорином, степень повышения концентраций опиоидов, метаболизируемых CYP3A, в плазме крови может быть выше. Следует проводить тщательный клинический мониторинг на предмет угнетения дыхания и/или затянувшегося седативного состояния при одновременном применении препарата Превимис в комбинации с циклоспорином и алфентанилом или фентанилом. См. соответствующие инструкции по медицинскому применению (см. раздел 4.4). |
Антиаритмические лекарственные препараты |
||
Амиодарон |
Взаимодействие не изучалось. |
Летермовир может увеличивать концентрации амиодарона в плазме крови. |
Хинидин |
Взаимодействие не изучалось. |
Летермовир может увеличивать концентрации хинидина в плазме крови. |
Лекарственные средства, действующие на сердечно-сосудистую систему |
||
Дигоксин¶ |
↔ дигоксин |
Коррекция дозы не требуется. |
Ингибиторы протонной помпы |
||
Омепразол |
Взаимодействие не изучалось. |
Летермовир может снижать концентрации субстратов CYP2C19 в плазме крови. |
Пантопразол |
Взаимодействие не изучалось. |
Летермовир может снижать концентрации субстратов CYP2C19 в плазме крови. |
Психостимуляторы |
||
Модафинил |
Взаимодействие не изучалось. |
Модафинил может снижать концентрации летермовира в плазме крови. |
*Данная таблица не является всеобъемлющей. |
||
Дети
Исследования взаимодействия проведены только у взрослых.
4.6. Фертильность, беременность и лактация
Беременность
Данные о применении летермовира у беременных женщин отсутствуют. Исследования на животных выявили репродуктивную токсичность (см. раздел 5.3).
Препарат Превимис не рекомендуется применять во время беременности и женщинам репродуктивного возраста, не применяющим контрацепцию.
Лактация
Неизвестно, выделяется ли летермовир с грудным молоком.
Полученные фармакокинетические/токсикологические данные у животных показали, что летермовир выделяется с молоком (см. раздел 5.3).
Нельзя исключать риск для новорожденных/грудных детей.
В период грудного вскармливания препарат Превимис применяют только в случае, если предполагаемая польза для матери превышает потенциальный риск для ребенка.
Фертильность
Влияния препарата на фертильность у крыс не обнаружено. Необратимая тестикулярная токсичность и нарушение фертильности наблюдалось у самцов крыс, но не у самцов мышей или самцов обезьян.
4.7. Влияние на способность управлять транспортными средствами и работать с механизмами
Препарат Превимис может оказывать незначительное влияние на способность управлять транспортными средствами и работать с механизмами. У некоторых пациентов во время лечения препаратом Превимис были описаны утомляемость и головокружение, которые могут влиять на способность пациента управлять транспортными средствами и работать с механизмами (см. раздел 4.8).
4.8. Нежелательные реакции
Резюме профиля безопасности
Оценка безопасности применения препарата Превимис основана на клиническом исследовании фазы III (P001) у реципиентов с ТГСК, которые получали препарат Превимис или плацебо в течение 14 недель после трансплантации и наблюдались в отношении безопасности применения препарата в течение 24 недель после трансплантации (см. раздел 5.1).
Наиболее часто регистрировавшимися нежелательными реакциями, которые возникали не менее чем у 1% пациентов в группе препарата Превимис и с частотой больше, чем в группе плацебо, были: тошнота (7,2%), диарея (2,4%) и рвота (1,9%).
Наиболее часто регистрировавшимися нежелательными реакциями, которые приводили к отмене препарата Превимис, были тошнота (1,6%), рвота (0,8%) и боль в животе (0,5%).
Табличное резюме нежелательных реакций
У пациентов, принимавших препарат Превимис в клинических исследованиях, были отмечены следующие нежелательные реакции. Нежелательные реакции перечислены ниже в зависимости от системно-органного класса и частоты. Частоты определяются следующим образом: очень частые (≥1/10), частые (≥1/100 и <1/10), нечастые (≥1/1000 и <1/100), редкие (≥1/10000 и <1/1000) или очень редкие (<1/10000).
Таблица 2. Нежелательные реакции, связанные с приемом препарата Превимис
Частота |
Нежелательные реакции |
Нарушения со стороны иммунной системы |
|
Нечастые |
гиперчувствительность |
Нарушения метаболизма и питания |
|
Нечастые |
снижение аппетита |
Нарушения со стороны нервной системы |
|
Нечастые |
дисгевзия, головная боль |
Нарушения со стороны органа слуха и лабиринта |
|
Нечастые |
головокружение |
Желудочно-кишечные нарушения |
|
Частые |
тошнота, диарея, рвота |
Нечастые |
боль в животе |
Нарушения со стороны печени и желчевыводящих путей |
|
Нечастые |
повышение уровня аланинаминотрансферазы, повышение уровня аспартатаминотрансферазы |
Нарушения со стороны мышечной, скелетной и соединительной ткани |
|
Нечастые |
мышечные спазмы |
Нарушения со стороны почек и мочевыводящих путей |
|
Нечастые |
повышение уровня креатинина в крови |
Общие нарушения и реакции в месте введения |
|
Нечастые |
усталость, периферические отеки |
Сообщения о подозреваемых нежелательных реакциях
Важно сообщать о подозреваемых нежелательных реакциях после регистрации лекарственного препарата с целью обеспечения непрерывного мониторинга соотношения «польза – риск» лекарственного препарата. Медицинским работникам рекомендуется сообщать о любых подозреваемых нежелательных реакциях лекарственного препарата через национальные системы сообщения о нежелательных реакциях государств – членов Евразийского экономического союза.
Россия
Адрес: 109012, г. Москва, Славянская площадь, д. 4, стр. 1.
Уполномоченная организация: Федеральная служба по надзору в сфере здравоохранения (Росздравнадзор)
Телефон: +7 (495) 698-45-38, +7 (499) 578-02-30
Электронная почта: info@roszdravnadzor.ru
Сайт в информационно-телекоммуникационной сети «Интернет»: http://www.roszdravnadzor.gov.ru
4.9. Передозировка
Информация о передозировке препаратом Превимис у человека отсутствует. Во время клинических исследований I фазы 86 здоровых добровольцев получали дозы препарата Превимис в диапазоне от 720 мг/сутки до 1440 мг/сутки в течение 14 дней. Профиль нежелательных реакций был аналогичен таковому для клинической дозы 480 мг/сутки. Специфического антидота при передозировке препаратом Превимис не существует. В случае передозировки рекомендуется наблюдать за состоянием пациента на наличие нежелательных реакций, и назначить соответствующее симптоматическое лечение.
Неизвестно, приведет ли гемодиализ к значимому удалению препарата Превимис из системного кровотока.
5. Фармакологические свойства
5.1. Фармакодинамические свойства
Фармакотерапевтическая группа: противовирусные средства системного действия, противовирусные средства прямого действия, другие противовирусные средства. Код АТХ: J05AX18.
Механизм действия
Летермовир ингибирует комплекс терминазы с ДНК цитомегаловируса (ЦМВ), необходимый для рестрикции и упаковки ДНК потомства вируса. Летермовир влияет на формирование единиц геномов правильной длины и нарушает созревание вириона.
Противовирусная активность
Медианное значение половинной максимальной эффективной концентрации (EC50) летермовира в отношении набора клинических изолятов ЦМВ на модели развития инфекции в культуре клеток составило 2,1 нмоль (диапазон от 0,7 нмоль до 6,1 нмоль, n=74).
Вирусная резистентность
В культуре клеток
Гены ЦМВ UL51, UL56 и UL89 кодируют субъединицы терминазы ДНК ЦМВ. Существование мутантных вариантов ЦМВ со сниженной чувствительностью к летермовиру было подтверждено в культуре клеток. Значения EC50 для рекомбинантных мутантных вариантов ЦМВ с экспрессией замен, расположенных в генах pUL51 (P91S), pUL56 (C25F, S229F, V231A, V231L, V236A, T244K, T244R, L254F, L257F, L257I, F261C, F261L, F261S, Y321C, L328V, M329T, A365S, N368D) и pUL89 (N320H, D344E), были в 1.6 — <10 раза выше, чем у референтного вируса дикого типа; эти замены, скорее всего, клинически незначимы. Значения EC50 для рекомбинантных мутантных вариантов ЦМВ с экспрессией pUL56 замен N232Y, V236L, V236M, E237D, E237G, L241P, K258E, C325F, C325R, C325W, C325Y, R369G, R369M, R369S и R369T были в 10-9,3 раза выше, чем у референтного вируса дикого типа; некоторые из этих замен были обнаружены у пациентов, у которых в клинических исследованиях отмечалась неэффективность профилактического лечения (см. ниже).
В клинических исследованиях
В исследовании фазы IIb с участием 131 реципиентов с ТГСК при изучении применения доз летермовира 60, 120 или 240 мг/сутки или плацебо до 84 дней, был выполнен анализ последовательности ДНК выбранного участка UL56 (аминокислоты с 231 по 369) в доступных образцах, полученных у 12 пациентов, у которых профилактика летермовиром оказалась неэффективной. У одного пациента, получавшего дозу 60 мг/сутки, был обнаружен резистентный к летермовиру генотипический вариант (ГВ) (V236M).
В исследовании фазы III (P001) был выполнен анализ последовательности ДНК всех кодирующих участков UL56 и UL89 в доступных образцах, которые были получены от 40 пациентов популяции анализа с полной выборкой (full analysis set, FAS), у которых профилактика летермовиром оказалась неэффективной. У двух пациентов был обнаружен резистентный к летермовиру ГВ (V236M) с заменами, расположенными в pUL56. У одного пациента была обнаружена замена V236M, у другого пациента – замена E237G. У еще одного пациента, у которого исходно выявлялась ДНК ЦМВ (и поэтому он не был в популяции FAS), после отмены летермовира были выявлены замены pUL56 (C325W и R369T).
Перекрестная резистентность
Возникновение перекрестной резистентности с лекарственными средствами, имеющими другой механизм действия, маловероятно. Летермовир полностью активен против вирусных популяций с заменами, обусловливающие устойчивость к ингибиторам ДНК-полимеразы ЦМВ (ганцикловир, цидофовир и фоскарнет). Набор рекомбинантных штаммов ЦМВ с заменами, которые обусловливают резистентность к летермовиру, был полностью чувствителен к цидофовиру, фоскарнету и ганцикловиру, за исключением рекомбинантного штамма с заменой pUL56 E237G, которая обусловливала снижение чувствительности к ганцикловиру в 2,1 раза по сравнению с диким типом.
Влияние на интервал QTc
Влияние летермовира в дозах до 960 мг при в/в введении на интервал QTc было оценено во время исследования QT у 38 здоровых добровольцев в рандомизированном, плацебо- и активно-контролируемом исследовании с однократной дозой (моксифлоксацин 400 мг внутрь), с 4-периодным перекрестным дизайном. Летермовир не удлиняет интервал QTc в какой-либо клинически значимой степени после применения в/в дозы 960 мг с концентрациями в плазме приблизительно в 2 раза выше, чем после применения в/в дозы 480 мг.
Клиническая эффективность и безопасность
Взрослые ЦМВ-серопозитивные реципиенты [R+] с аллогенной трансплантацией гемопоэтических стволовых клеток
С целью изучения профилактики летермовиром в качестве превентивной стратегии в отношении ЦМВ-инфекции или ЦМВ-заболеваний, эффективность летермовира была оценена в многоцентровом, двойном-слепом, плацебо-контролируемом исследовании фазы III (P001) у взрослых ЦМВ‑серопозитивных реципиентов [R+] с аллогенной ТГСК. Пациенты были рандомизированы в соотношении (2:1) в группы, получавшие летермовир в дозе 480 мг 1 раз в сутки с ее коррекцией до 240 мг при одновременном применении с циклоспорином, или плацебо. Рандомизация была стратифицирована по исследовательским центрам и риску (высокий или низкий) реактивации ЦМВ на момент включения в исследование. Применение летермовира начинали после ТГСК (на 0-28 день после трансплантации) и продолжали 14 недель после трансплантации. Летермовир назначался перорально или в/в; доза летермовира была одинаковой независимо от пути введения. Состояние пациентов относительно первичной конечной точки эффективности отслеживалось в течение 24 недель после трансплантации, и последующее наблюдение продолжалось в течение 48 недель после трансплантации.
У пациентов еженедельно в течение 14 недель после трансплантации проводился мониторинг ДНК ЦМВ с последующим мониторингом каждые две недели в течение 24 недель после трансплантации, с назначением стандартной превентивной терапии ЦМВ (pre-emptive therapy, PET), если содержание ДНК ЦМВ в крови расценивалось как клинически значимое. Последующее наблюдение пациентов продолжалось в течение 48 недель после трансплантации.
Среди 565 получивших лечение пациентов 373 пациента получали летермовир (из которых 99 пациентов получили хотя бы 1 в/в дозу) и 192 получали плацебо (из которых 48 пациентов получили хотя бы 1 в/в дозу). Медиана времени начала применения летермовира составила 9 дней после трансплантации. У 37% пациентов исходно наблюдалось приживление трансплантата. Медиана возраста составила 54 года (диапазон: 18-78 лет); 56 (15,0%) пациентов были в возрасте 65 лет и старше: 58% были мужчинами; 82% были европеоидами; 10% были азиатского происхождения; 2% были негроидами или имели африканское происхождение; и 7% были испаноязычного или латиноамериканского происхождения. Исходно, 50% пациентов получили миелоаблативный режим кондиционирования, 52% получали циклоспорин и 42% получали такролимус. Наиболее частыми основными причинами для трансплантации были острый миелоидный лейкоз (38%), миелобластный синдром (15%) и лимфома (13%). У двенадцати процентов (12%) пациентов исходно была обнаружена ДНК ЦМВ.
Исходно 31% пациентов имел высокий риск реактивации, установленный на основании следующих критериев (одного или более):
- родственный донор (брат или сестра) человеческих лейкоцитарных антигенов (HLA) с хотя бы одним несовпадением по одному из следующих трех локусов генов HLA: HLA-A, -B или -DR, гаплоидентичный донор;
- неродственный донор с хотя бы одним несовпадением по одному из следующих четырех локусов генов: HLA-A, -B, -C и -DRB1;
- использование в качестве источника стволовых клеток пуповинной крови; использование трансплантатов, из которых ex vivo были удалены T-клетки;
- реакция «трансплантат против хозяина» (РТПХ) второй и более степени, требующая назначения системных кортикостероидов.
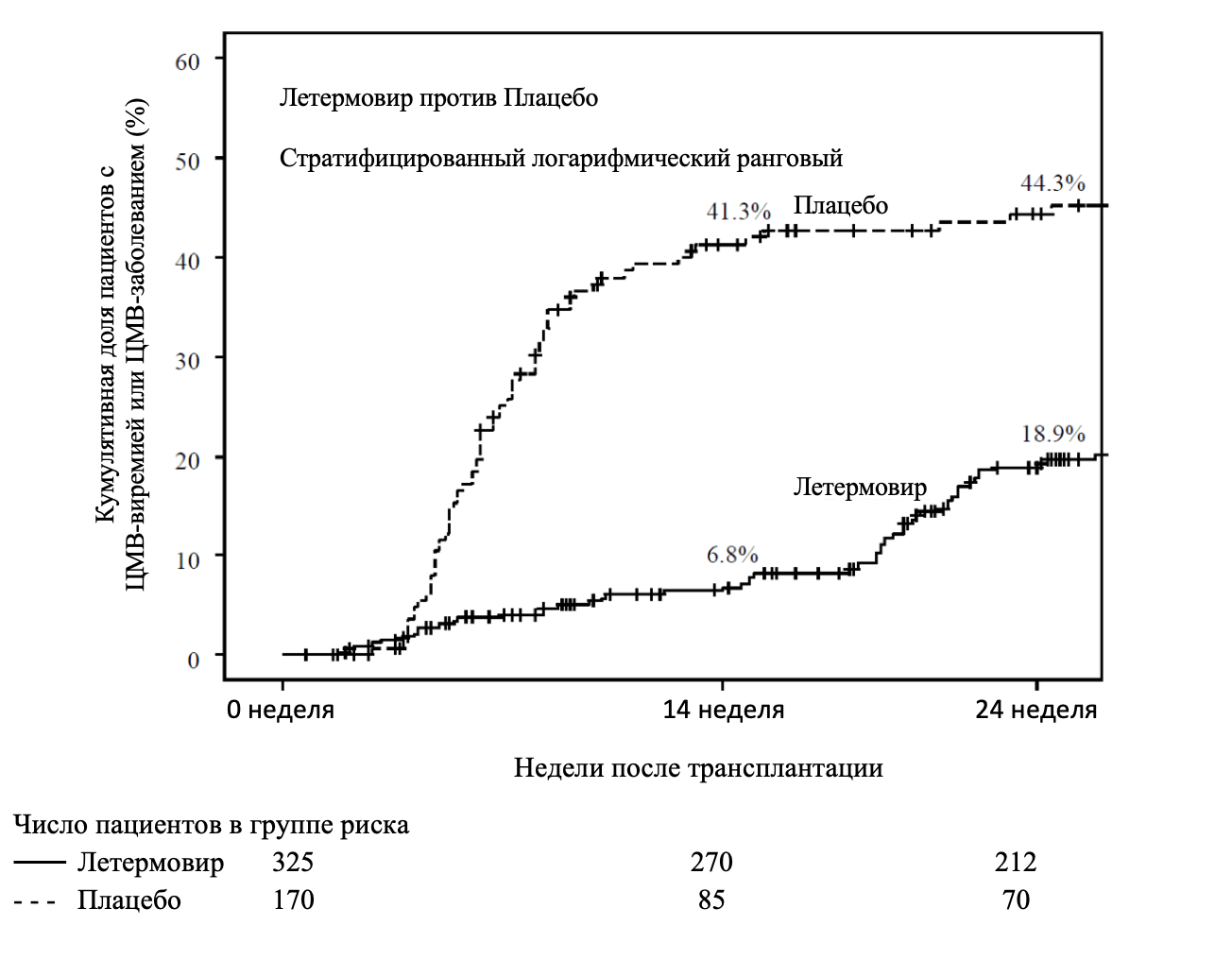
Первичная конечная точка эффективности
Первичная конечная точка эффективности клинически значимой ЦМВ-инфекции в исследовании P001 была определена как частота ЦМВ-виремий, требующих PET против ЦМВ или возникновение ЦМВ-заболевания органов-мишеней. Использовался подход «Не завершивший исследование = неудача (НЗ=Н)», при котором пациентов, выбывших из исследования до 24 недели после трансплантации или у которых отсутствовали данные по исходам на 24 неделе после трансплантации, учитывали как случаи неудачи.
Летермовир при анализе первичной конечной точки продемонстрировал более высокую эффективность по сравнению с плацебо, как показано в таблице 3. Расчетная разница между группой летермовира и группой плацебо в -23,5% была статистически достоверна (одностороннее p‑значение <0,0001)
Таблица 3. Исследование P001: Результаты эффективности у реципиентов с ТГСК (Подход НЗ=Н, популяция FAS)
Параметр |
Летермовир | Плацебо |
Первичная конечная точка эффективности (доля пациентов с неудачной профилактикой на 24 неделе) |
122 (37,5) | 103 (60,6) |
Причины неудачи† |
||
Клинически значимая ЦМВ-инфекция |
57 (17,5) |
71 (41,8) |
ЦМВ-ДНКемия, требующая превентивной терапии против ЦМВ |
52 (16,0) |
68 (40,0) |
ЦМВ-заболевание органов-мишеней |
5 (1,5) |
3 (1,8) |
Выбыли из исследования |
56 (17,2) |
27 (15,9) |
Исходы неизвестны |
9 (2,8) |
5 (2,9) |
Разница лечения скорректированная по страте (Летермовир – Плацебо)§ |
||
Разница (95% ДИ) |
-23,5 (-32,5, -14,6) |
|
-23,5 (-32,5, -14,6) |
<0,0001 |
|
†Категории неудачи взаимно исключали друг друга и основывались на иерархии категорий в перечисленном порядке. |
||
Факторы, ассоциированные с ЦМВ-виремией после 14 недели после трансплантации, среди пациентов, получавших летермовир, включали исходно высокий риск реактивации ЦМВ, РТПХ, применение кортикостероидов и ЦМВ-негативный серостатус донора.
Рисунок 1. Исследование P001: График Каплана-Майера зависимости времени до начала превентивной терапии против ЦМВ или начала поражения органов-мишеней ЦМВ до 24 недели после трансплантации у реципиентов с ТГСК (популяция FAS).
|
Различий по частоте или срокам приживления ТГСК между группами препарата Превимис и плацебо не обнаружено.
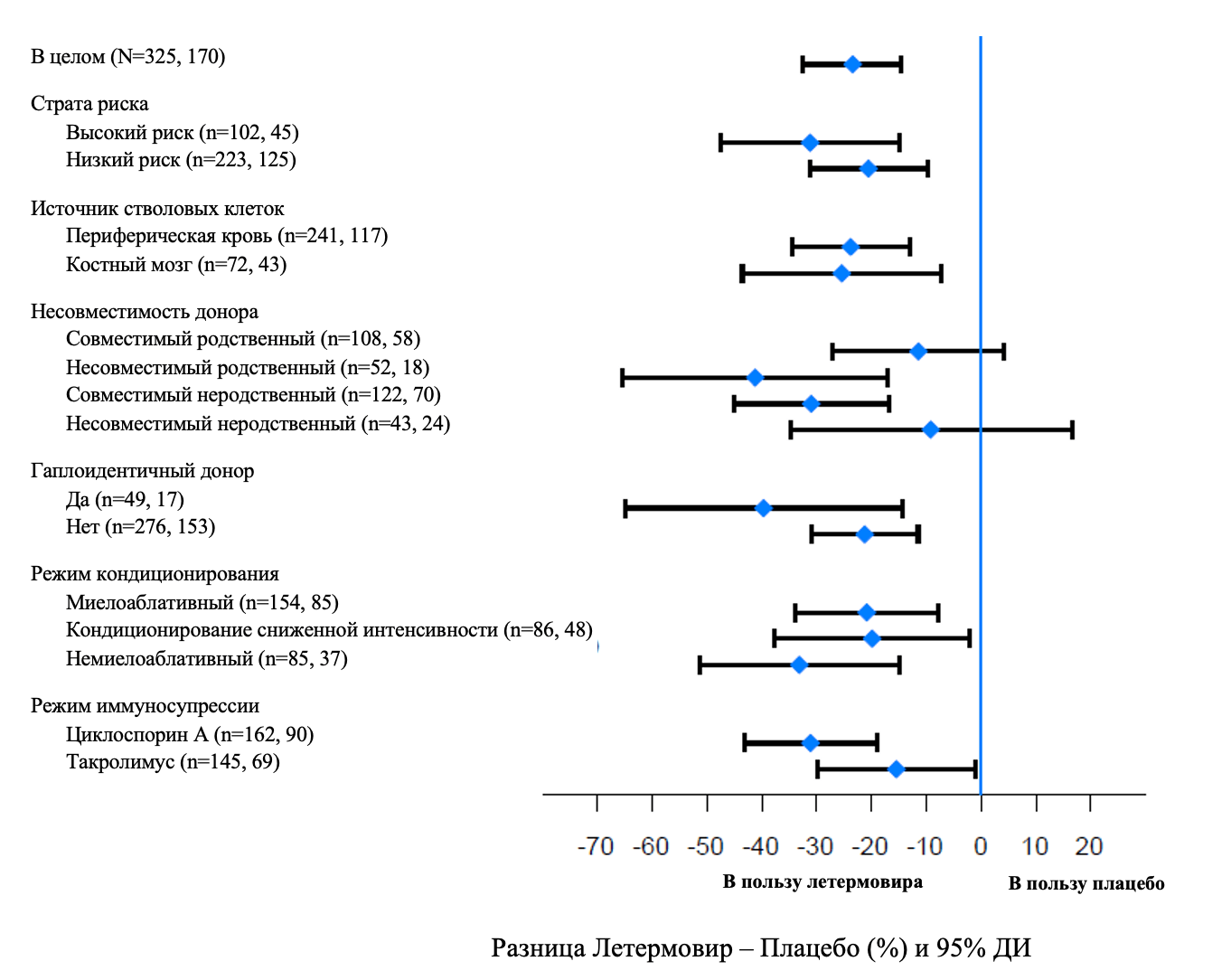
Результаты по эффективности стабильно свидетельствовали в пользу летермовира во всех подгруппах, включая с низким и высоким риском реактивации ЦМВ, различных режимах кондиционирования и одновременно применяемых иммунодепрессивных режимов (см. Рисунок 2).
Рисунок 2. Исследование P001: Форест-диаграмма доли пациентов, начавших превентивную терапию против ЦМВ, или с ЦМВ-заболеванием органов-мишеней до 24 недели после трансплантации, в выбранных подгруппах (подход НЗ=Н, популяция FAS)
|
НЗ=Н, подход «Не завершивший исследование=Неудача». При использовании подхода НЗ=Н, пациенты, которые выбыли из исследования до 24 недели после трансплантации или у которых отсутствовала информация об исходе на 24 неделе после трансплантации, учитывались, как случаи неудач.
5.2. Фармакокинетические свойства
Фармакокинетические характеристики летермовира были описаны у здоровых добровольцев и реципиентов с ТГСК после перорального и в/в введения. Экспозиция летермовира возрастала нелинейно, как после перорального, так и после в/в введения. Механизм, вероятно, связан с насыщением/аутоингибированием OATP1B1/3.
Фармакокинетические характеристики летермовира были описаны у здоровых добровольцев и реципиентов с ТГСК после перорального и в/в введения. Экспозиция летермовира возрастала нелинейно, как после перорального, так и после в/в введения. Механизм, вероятно, связан с насыщением/аутоингибированием OATP1B1/3.
Средние геометрические значения площади под кривой «концентрация – время» (AUC) и значения Cmax в равновесном состоянии после перорального приема 480 мг летермовира 1 раз в сутки здоровыми добровольцами составили 71 500 нг•ч/мл и 13 000 нг/мл, соответственно.
AUC летермовира у реципиентов с ТГСК оценивалась с помощью популяционного фармакокинетического анализа с использованием данных фазы III (см. таблицу 4). Различия в экспозиции между схемами лечения клинически незначимы; эффективность была стабильна для всего диапазона экспозиций, которые наблюдались в исследовании P001.
Таблица 4. Значения AUC летермовира (нг•ч/мл) у реципиентов с ТГСК
Режим лечения |
Медиана (90% интервал прогнозирования)* |
480 мг перорально, без циклоспорина |
34 400 (16 900, 73 700) |
480 мг в/в, без циклоспорина |
100 000 (65 300, 148 000) |
240 мг перорально, с циклоспорином |
60 800 (28 700, 122 000) |
240 мг в/в, с циклоспорином |
70 300 (46 200, 106 000) |
* Популяционные апостериорные предположения на основании популяционного ФК анализа с использованием данных фазы III. |
|
Абсорбция
Летермовир быстро всасывается с медианой времени достижения максимальной концентрации в плазме (Tmax) от 1,5 ч до 3,0 ч, его концентрация снижается двухфазным образом. Биодоступность летермовира у реципиентов с ТГСК при пероральном приеме летермовира 480 мг 1 раз в сутки, применявшегося без циклоспорина, составила около 35%. Межиндивидуальная вариабельность биодоступности составила около 37%.
Влияние циклоспорина
У реципиентов с ТГСК одновременное применение летермовира с циклоспорином увеличивало концентрации летермовира в плазме крови вследствие ингибирования OATP1B. Биодоступность летермовира у пациентов при пероральном приеме летермовира 240 мг 1 раз в сутки одновременно с циклоспорином по оценке составила около 85%.
Если летермовир применяется одновременно с циклоспорином, рекомендуемая доза летермовира составляла 240 мг 1 раз в сутки (см. раздел 4.2).
Влияние пищи
У здоровых добровольцев однократный пероральный прием летермовира в дозе 480 мг вместе со стандартным высококалорийным приемом пищи с высоким содержанием жиров не оказывал никакого влияния на AUC и приводил примерно к 30% повышению Cmax летермовира. Таким образом, при пероральном применении летермовир может назначаться независимо от приема пищи, как это было продемонстрировано в рамках клинических исследований (см. раздел 4.2).
Распределение
На основании популяционного фармакокинетического анализа средний объем распределения в равновесном состоянии после в/в введения у реципиентов с ТГСК по оценке составил 45,5 л.
Летермовир в значительной степени связывается (98,2%) с белками плазмы человека независимо от диапазона концентраций (от 3 до 100 мг/л), изученных in vitro. Некоторое насыщение наблюдалось при низких концентрациях. Распределение летермовира между кровью и плазмой составляет 0,56 и не зависит от изученного in vitro диапазона концентраций (0,1‑10 мг/л).
В доклинических исследованиях распределения летермовир распределялся в органы и ткани с максимальными концентрациями, обнаруженными в желудочно-кишечном тракте, желчных протоках и печени и с низкими концентрациями в головном мозге.
Биотрансформация
Большинство связанных с летермовиром компонентов в плазме представляют собой неизмененное исходное вещество (96,6%). Никаких основных метаболитов в плазме крови выявлено не было. Летермовир частично элиминируется путем глюкуронирования, опосредованного UGT1A1/1A3.
Элиминация
Средний кажущийся конечный период полувыведения летермовира у здоровых добровольцев составляет около 12 ч при в/в введении 480 мг летермовира. Основными путями выведения летермовира являются экскреция с желчью, а также прямое глюкуронирование. В этом процессе участвуют транспортные белки печеночного захвата OATP1B1 и 3, с последующим глюкуронированием, катализируемым UGT1A1/3.
На основании популяционного фармакокинетического анализа кажущийся клиренс летермовира в равновесном состоянии после в/в введения 480 мг реципиентам с ТГСК определен как 4,84 л/час. Межиндивидуальная вариабельность клиренса по оценке составила 24,6%.
После перорального приема радиоактивно-меченого летермовира 93,3% дозы было обнаружено в кале. Большая часть летермовира подвергалась экскреции с жёлчью в виде неизмененного исходного вещества с небольшим количеством (6% дозы) в виде ацилглюкуронидного метаболита в кале. Ацилглюкуронид в кале нестабилен. Экскреция летермовира с мочой была незначительной (<2% дозы).
Фармакокинетика у особых групп пациентов
Пациенты с нарушением функции печени
AUC несвязанного летермовира у пациентов со средней (класс В по Чайлд-Пью [ЧП-B], оценка 7-9) и тяжелой степенью (класс С по Чайлд-Пью [ЧП-C], оценка 10-15) нарушения функции печени приблизительно на 81% и в 4 раза, соответственно, была выше по сравнению со здоровыми добровольцами. Изменения экспозиции летермовира у пациентов со средней степенью нарушения функции печени не являются клинически значимыми.
У пациентов со средней степенью нарушения функции печени в комбинации со средней или тяжелой степенью нарушения функции почек следует ожидать заметного повышения экспозиции несвязанного летермовира (см. раздел 4.2).
Пациенты с нарушением функции печени
AUC несвязанного летермовира у пациентов со средней (класс В по Чайлд-Пью [ЧП-B], оценка 7-9) и тяжелой степенью (класс С по Чайлд-Пью [ЧП-C], оценка 10-15) нарушения функции печени приблизительно на 81% и в 4 раза, соответственно, была выше по сравнению со здоровыми добровольцами. Изменения экспозиции летермовира у пациентов со средней степенью нарушения функции печени не являются клинически значимыми.
Пациенты с нарушением функции почек
AUC несвязанного летермовира у пациентов со средней (расчётная скорость клубочковой фильтрации (рСКФ) от 31,0 до 56,8 мл/мин/1,73м2) и тяжелой (рСКФ от 11,9 до 28,1 мл/мин/1,73м2) степенью нарушения функции почек по сравнению со здоровыми добровольцами была выше приблизительно на 115 и 81%, соответственно. Изменения экспозиции летермовира вследствие средней или тяжелой степени нарушения функции почек не считаются клинически значимыми. Пациенты с терминальной стадией почечной недостаточности не изучались.
Вес
По оценке данных популяционного фармакокинетического анализа AUC летермовира была на 18,7% ниже у пациентов, имеющих вес 80‑100 кг, по сравнению с пациентами, имеющих вес 67 кг. Это различие клинически незначимо.
Расовая принадлежность
По оценке данных популяционного фармакокинетического анализа AUC летермовира была на 33,2% выше у лиц азиатского происхождения по сравнению с европеоидами. Это изменение клинически не значимо.
Пол
По данным популяционного фармакокинетического анализа различия в фармакокинетике летермовира у женщин по сравнению с мужчинами отсутствуют.
Пожилые пациенты
По данным популяционного фармакокинетического анализа возраст не оказывает влияния на фармакокинетику летермовира. Коррекция дозы в зависимости от возраста не требуется.
5.3 Данные доклинической безопасности
Общая токсичность
Необратимая тестикулярная токсичность отмечалась только у крыс при системных экспозициях в (AUC) ≥ 3 раза от экспозиции у человека при рекомендованной дозе для человека (РДЧ). Эта токсичность характеризовалась дегенерацией семенных канальцев и олигоспермией, а также клеточным детритом в придатках яичка, при этом снижалась масса яичек и придатков яичка. У крыс не наблюдалось тестикулярной токсичности при экспозициях (AUC), которые были аналогичны экспозициям у человека при РДЧ. Тестикулярная токсичность не наблюдалась у мышей и обезьян на фоне максимальных изучавшихся доз при экспозициях, которые превышали экспозиции у человека при РДЧ в 4 раза и 2 раза, соответственно. Значимость для человека неизвестна.
Канцерогенность
Исследований канцерогенности с летермовиром не проводилось.
Мутагенность
Летермовир не проявлял генотоксичности по данным ряда in vitro или in vivo анализов, включая анализы мутагенеза у микробов, хромосомных аберраций в клетках яичника китайского хомяка, и микроядерного исследования in vivo на мышах.
Репродуктивность
Фертильность
В исследованиях фертильности и раннего эмбрионального развития у крыс не отмечалось влияния летермовира на фертильность самок. У самцов крыс наблюдались снижение концентрации сперматозоидов, снижение подвижности сперматозоидов и снижение фертильности на фоне системных экспозиций в ≥ 3 раза выше AUC у человека при РДЧ (см. «Общая токсичность»).
У обезьян, которым вводился летермовир, не было признаков тестикулярной токсичности по данным гистопатологической оценки, измерения размеров яичек, определения гормонов в крови (фолликулостимулирующий гормон, ингибин B и тестостерон) и оценки спермы (количество спермы, подвижность и морфология сперматозоидов) при системных экспозициях, которые приблизительно в 2 раза превышали от AUC у человека при РДЧ.
Развитие
У крыс токсическое воздействие на организм беременной самки (включающее снижение прибавки массы тела) было отмечено при 250 мг/кг/сутки (приблизительно в 11 раз выше AUC при РДЧ); у потомства наблюдались снижение массы тела плодов с замедленной оссификацией, некоторая отечность плодов и увеличенная частота случаев укороченных пуповин, а также вариантов и аномалий строения позвонков, ребер и таза. Никакого влияния на организм беременной самки или развитие плода на фоне дозы 50 мг/кг/сутки (приблизительно в 2,5 раза выше AUC при РДЧ) отмечено не было.
У кроликов токсическое воздействие на организм беременной самки (включавшее смертность и выкидыши) было отмечено при 225 мг/кг/сутки (приблизительно в 2 раза выше AUC при РДЧ); у потомства наблюдалась повышенная частота аномалий и вариантов строения позвонков и ребер.
В исследовании влияния на пре- и постнатальное развитие летермовир вводился беременным самкам крыс перорально. На фоне максимальных изучавшихся доз (в 2 раза выше AUC при РДЧ) не отмечалось никакого токсического воздействия на развивающийся организм.
6. Фармацевтические свойства
6.1. Перечень вспомогательных веществ
Ядро таблетки:
Целлюлоза микрокристаллическая (E460)
Кроскармеллоза натрия (E468)
Повидон 25 (E1201)
Кремния диоксид коллоидный безводный (E551)
Магния стеарат (E470b)
Пленочная оболочка таблетки:
Таблетки 240 мг:
Опадрай® II желтый 39K120004 (гипромеллоза 2910 6 cP (E464), гипромеллоза 2910 15 cP (E464), триацетин, лактозы моногидрат, титана диоксид (E171), краситель железа оксид желтый (E172))
Воск карнаубский (E903)
Таблетки 480 мг:
Опадрай® II розовый 39K140009 (гипромеллоза 2910 6 cP (E464), гипромеллоза 2910 15 cP (E464), триацетин, лактозы моногидрат, титана диоксид (E171), краситель железа оксид желтый (E172), краситель железа оксид красный (E172)) Воск карнаубский (E903)
6.2. Несовместимость
Не применимо.
6.3. Срок годности (срок хранения)
3 года
6.4. Особые меры предосторожности при хранении
Хранить при температуре ниже 30 °С. Хранить в блистере для защиты от влаги.
6.5. Характер и содержание первичной упаковки
Превимис, 240 мг, таблетки, покрытые пленочной оболочкой
По 7 таблеток в блистер из ПА/Ал/ПВХ – Ал. По 4 блистера вместе с листком-вкладышем в картонную пачку. Может присутствовать контроль вскрытия упаковки.
Превимис, 480, мг таблетки, покрытые пленочной оболочкой
По 7 таблеток в блистер из ПА/Ал/ПВХ – Ал. По 4 блистера вместе с листком-вкладышем в картонную пачку. Может присутствовать контроль вскрытия упаковки.
6.6. Особые меры предосторожности при уничтожении использованного лекарственного препарата или отходов, полученных после применения лекарственного препарата, и другие манипуляции с препаратом
Весь оставшийся лекарственный препарат или отходы следует уничтожить в установленном порядке.
7. Держатель регистрационного удостоверения
РоссияООО «МСД Фармасьютикалс»
ул. Тимура Фрунзе, д. 11, стр. 1
г. Москва, Россия, 119021
тел.: (495) 916-71-00
факс: (495) 916-70-94
7.1. Представитель держателя регистрационного удостоверения.
Претензии потребителей направлять по адресу:
Россия
ООО «МСД Фармасьютикалс»
ул. Тимура Фрунзе, д. 11, стр. 1
г. Москва, Россия, 119021
тел.: (495) 916-71-00
факс: (495) 916-70-94
электронная почта: dpoc.russia@merck.com
8. Номер регистрационного удостоверения
9. Дата первичной регистрации (подтверждения регистрации, перерегистрации)
Дата первичной регистрации: 01.06.2022
10. Дата пересмотра текста
Общая характеристика лекарственного препарата доступна на информационном портале Евразийского экономического союза в информационно-коммуникационной сети «Интернет».
RU-NON-01110-02-23