Вакцины
Инструкция по медицинскому применению лекарственного препарата РотаТек®
Инструкция по медицинскому применению лекарственного препарата
13063
Регистрационный номер
ЛП-001865
Торговое наименование
РотаТек®
Группировочное наименование
вакцина для профилактики ротавирусной инфекции, пентавалентная, живая
Лекарственная форма
раствор для приема внутрь
Состав
Одна доза (2 мл) содержит:
Действующие вещества
Живые реассортанты человеческого и бычьего ротавирусов, выращенные на культуре клеток Веро:
Ротавирус типа G1 – не менее 2,2х106 ИЕ*
Ротавирус типа G2 – не менее 2,8х106 ИЕ*
Ротавирус типа G3 – не менее 2,2х106 ИЕ*
Ротавирус типа G4 – не менее 2,0х106 ИЕ*
Ротавирус типа P1A[8] – не менее 2,3х106 ИЕ*
* ИЕ – инфекционная единица
Вспомогательные вещества
Сахароза 1080 мг, натрия гидроксид 2,75 мг, натрия цитрата дигидрат 127 мг, натрия дигидрофосфата моногидрат 29,8 мг, полисорбат‑80 от 0,17 до 0,86 мг, ротавирусный растворитель и среда LPKM-3. Суммарный объем культуральной среды LPKM-3 из вирусных балков и ротавирусного растворителя составляет 15% от общего объема вакцины.
Описание
Прозрачная жидкость бледно-желтого цвета; допустимо наличие розового оттенка.
Характеристика
РотаТек® – это живая пероральная пентавалентная вакцина, содержащая пять живых реассортантных штаммов ротавируса. Ротавирусные родительские штаммы реассортантов были изолированы из организмов человека и быка. Четыре вакцинных реассортанта ротавируса экспрессируют один из наружных капсидных белков VP7 (серотипы G1, G2, G3 или G4) человеческого родительского штамма ротавируса и белок VP4 (серотип P7[5]) бычьего родительского штамма ротавируса (белок VP4 отвечает за прикрепление ротавируса к поверхности клеток). На поверхности пятого реассортанта вируса экспрессирован белок VP4 (серотип P1A[8]) человеческого родительского штамма ротавируса и наружный капсидный белок VP7 (серотип G6) бычьего родительского штамма ротавируса.
Каждый из реассортантов выращен по отдельности на культуре клеток Веро стандартными культуральными методами без использования противогрибковых препаратов. Затем реассортанты все вместе помещены в буферный стабилизирующий раствор.
Так как в производстве реассортантов, входящих в состав вакцины РотаТек®, используется биологический материал животного происхождения, в вакцине обнаружены малые фрагменты ДНК ЦВС‑1 и ЦВС‑2 (цирковирус свиней 1 и 2 типов), при этом сами вирусные частицы ЦВС‑1 и/или ЦВС‑2 в вакцине отсутствуют. В настоящее время неизвестны случаи заболевания человека, вызванные ЦВС‑1 и/или ЦВС‑2.
Вакцина РотаТек® не содержит тиомерсала и других консервантов.
Фармакотерапевтическая группа
МИБП‑вакцина
Код АТХ
J07BH02
Иммунобиологические свойства
В умеренной климатической зоне ротавирусный гастроэнтерит является сезонным заболеванием с увеличением заболеваемости (эпидемиями) в зимние месяцы. При отсутствии лечения ротавирусный гастроэнтерит может привести к летальной дегидратации.
Эффективность
По данным клинических исследований эффективность вакцины РотаТек® была продемонстрирована в отношении гастроэнтерита, вызванного ротавирусами генотипов G1P[8], G2P[4], G3P[8], G4P[8] и G9P[8].
Эффективность вакцины РотаТек® изучалась по 2 параметрам в плацебо-контролируемом исследовании эффективности и безопасности (REST):
- У 5673 вакцинированных детей (2834 ребенка в группе вакцины) эффективность измерялась как уменьшение числа случаев ротавирусного гастроэнтерита, вызванного генотипами G, входящими в вакцину (G1‑G4), который развивался через 14 дней после получения третьей дозы вакцины и на протяжении первого полного ротавирусного сезона после вакцинации.
- У 68038 вакцинированных детей (34035 детей в группе вакцины) эффективность защиты измерялась как уменьшение числа случаев госпитализаций и обращений за неотложной помощью по поводу ротавирусного гастроэнтерита, начиная с 14‑го дня после получения третьей дозы вакцины.
Результаты данных исследований представлены в таблицах.
| Уменьшение числа случаев ротавирусного гастроэнтерита на протяжении одного полного сезона после вакцинации (группа вакцины РотаТек® n=2834) (% [95% доверительный интервал (ДИ)]) | ||||||
| Эффективность против ротавирусного гастроэнтерита любой степени тяжести в зависимости от генотипа | ||||||
| Тяжелая* степень заболевания (G1‑G4) | Любая степень тяжести (G1‑G4) | G1 | G2 | G3 | G4 | G9 |
| 98,0% [88,3; 100,0]† | 74,0% [66,8; 79,9]† | 74,9% [67,3; 80,9]† | 63,4% [2,6; 88,2]† | 82,7% [<0; 99,6] | 48,1% [<0; 91,6] | 65,4% [<0; 99,3] |
* Тяжелая степень определялась как результат «больше 16 из 24» по валидированной клинической системе подсчета, основанной на интенсивности и продолжительности симптомов (лихорадки, рвоты, диареи, изменений поведения).
† Статистически значимо.
| Уменьшение числа госпитализаций и обращений за неотложной помощью по поводу ротавирусного гастроэнтерита на протяжении 2 лет после вакцинации (группа вакцины РотаТек® n=34035) (% [95% ДИ]) | |||||
| G1‑G4 | G1 | G2 | G3 | G4 | G9 |
| 94,5% [91,2; 96,6]† | 95,1% [91,6; 97,1]† | 87,6% [<0; 98,5] | 93,4% [49,4; 99,1]† | 89,1% [52,0; 97,5]† | 100% [69,6; 100,0]† |
† Статистически значимо.
Уменьшение числа случаев ротавирусного гастроэнтерита, вызванного генотипами G1‑G4 во время второго ротавирусного сезона после вакцинации, составило 88,0% [95% ДИ: 49,4; 98,7] для тяжелой степени заболевания и 62,6% [95% ДИ: 44,3; 75,4] для заболевания любой степени тяжести.
Эффективность против ротавируса генотипов G2P[4], G3P[8], G4P[8] и G9P[8] была рассчитана для меньшего числа случаев, чем для G1. Эффективность против генотипов G2P[4], скорее всего, связана c наличием реассортанта G2 в составе вакцины.
В комбинированном ретроспективном анализе исследования REST и другого исследования фазы 3 эффективность вакцины против ротавирусного гастроэнтерита (любой степени тяжести), вызванного G1-, G2-, G3- и G4‑серотипами, составила 61,5% [95% ДИ: 14,2; 84,2] среди детей, получивших третью дозу препарата в возрасте от 26 до 32 (включительно) недель.
В Финляндии было проведено дополнительное исследование в рамках исследования REST. В финском дополнительном исследовании (FES) наблюдали группу из 20736 детей, ранее участвовавших в исследовании REST. В исследовании FES детей наблюдали в течение до 3 лет после вакцинации.
В исследовании REST было сообщено о 403 случаях ротавирусного гастроэнтерита, связанного с генотипами G1‑G4 и G9 (20 случаев в группе вакцины и 383 в группе плацебо). В исследовании FES было отмечено дополнительно 136 случаев (9 в группе вакцины и 127 в группе плацебо). Число случаев для каждой группы в исследовании FES составляло 31% и 25% от суммы случаев для соответствующих групп в двух исследованиях.
На основе объединенных данных REST и FES уменьшение числа случаев госпитализаций и обращений за неотложной помощью по поводу ротавирусного гастроэнтерита в течение 3 лет после вакцинации составило 94,4% (95% ДИ: 91,6; 96,2) для генотипов G1‑G4, 95,5% (95% ДИ: 92,8; 97,2) для генотипа G1, 81,9% (95% ДИ: 16,1; 98,0) для генотипа G2, 89,0% (95% ДИ: 53,3; 98,7) для генотипа G3, 83,4% (95% ДИ: 51,2; 95,8) для генотипа G4 и 94,2% (95% ДИ: 62,2; 99,9) для генотипа G9. В течение третьего года в группе вакцины (3112 детей) обращений за медицинской помощью по поводу ротавирусного гастроэнтерита зафиксировано не было, а в группе плацебо (3126 детей) был отмечен 1 (нетипируемый) случай.
В клинических исследованиях было подтверждено, что для достижения необходимого уровня и длительности защиты против ротавирусного гастроэнтерита следует проводить полный курс вакцинации с введением 3 доз (см. СПОСОБ ПРИМЕНЕНИЯ И ДОЗЫ). Однако ретроспективный анализ данных показал, что даже до завершения полного курса вакцинации число случаев ротавирусного гастроэнтерита с такой степенью тяжести, которая потребовала бы госпитализацию или обращение за неотложной помощью, уменьшалось (через примерно 14 дней после введения первой дозы).
Эффективность у недоношенных детей
В исследовании REST вакцину РотаТек® ввели примерно 1000 детям, родившимся при сроке беременности от 25 до 36 недель. Эффективность вакцины РотаТек® у данной подгруппы не отличалась от подгруппы детей, родившихся в срок.
Пострегистрационное наблюдательное исследование по безопасности
В крупном проспективном пострегистрационном наблюдательном исследовании, проводившемся в США, был проанализирован риск болезни Кавасаки у 85150 детей, получивших одну или более доз вакцины РотаТек® (17433 пациенто‑лет наблюдения).
В течение 0–30 дней после введения вакцины не было статистически значимой разницы в частоте развития болезни Кавасаки по сравнению c частотой в общей популяции. Кроме того, не было статистически значимого повышения риска появления данного побочного эффекта при наблюдении в течение 30 дней после введения вакцины РотаТек® по сравнению с контрольной группой детей, получавших только вакцину АКДС (62617 детей, 12399 пациенто‑лет наблюдений). Один подтвержденный случай был зарегистрирован у детей, получавших вакцину РотаТек®, в сравнении с одним случаем у детей, получавших АКДС (относительный риск 0,7; 95% ДИ: 0,01; 55,56). Таким образом, никакого дополнительного риска, связанного с безопасностью, относительно общего профиля безопасности зафиксировано не было.
Данные исследований по эффективности
Пострегистрационные исследования, подтверждающие эффективность предотвращения ротавирусного гастроэнтерита.
| Дизайн исследования (страна) | Исследуемая популяция | Конечные точки | Эффективность в % [95% ДИ] | Сезоны заболеваемости ротавирусом |
| База данных обращений (США) |
33140 вакцинированных
26167 невакцинированных Возраст ≥7 месяцев Получено 3 дозы |
Госпитализации и обращения за неотложной помощью по поводу ротавирусного гастроэнтерита | 100% [87;100] | 2007-2008 |
| Амбулаторные обращения по поводу ротавирусного гастроэнтерита | 96% [76;100] | |||
| Госпитализации и обращения за неотложной помощью по поводу всех видов гастроэнтерита | 59% [47;68] | |||
| Когортное исследование (Франция) |
1895 вакцинированных 3 дозами
2102 невакцинированных Возраст <2 лет |
Госпитализации по поводу ротавирусного гастроэнтерита | 98% [83;100] |
2007-2008
2008-2009 |
| Исследование случай-контроль (США) |
402 случаев
2559 контролей* Возраст <8 лет Получено 3 дозы |
Госпитализации и обращения за неотложной помощью по поводу ротавирусного гастроэнтерита | 80% [74;84] |
2011-2012
2012-2013 |
| Специфично по штаммам | ||||
| — G1P[8] | 89% [55;97] | |||
| — G2P[4] | 87% [65;95] | |||
| — G3P[8] | 80% [64;89] | |||
| — G12P[8] | 78% [71;84] | |||
| Специфично по возрасту | ||||
| — 1‑й год жизни | 91% [78;96] | |||
| — 2‑й год жизни | 82% [69;89] | |||
| — 3‑й год жизни | 88% [78;93] | |||
| — 4‑й год жизни | 76% [51;88] | |||
| — 5‑й год жизни | 60% [16;81] | |||
| — 6‑й — 7‑й годы жизни | 69% [43;84] |
*Контроли — ротавирус-отрицательные случаи острого гастроэнтерита.
Иммуногенность
Механизм иммунной защиты организма вакциной РотаТек® от ротавирусного гастроэнтерита до конца не изучен. Взаимосвязь между содержанием антител к ротавирусам после вакцинации ротавирусными вакцинами и степенью защиты против ротавирусного гастроэнтерита не установлена. По данным клинических исследований фазы 3 после проведения полного курса вакцинации, состоящего из трех доз препарата РотаТек®, у 92,5–100% вакцинированных в сыворотке наблюдалось значительное повышение уровня анти‑ротавирусного IgA. Вакцина вызывает иммунный ответ, т.е. образование сывороточных нейтрализующих антител к пяти белкам ротавирусов человека, экспрессированных на реассортантах вакцины (G1, G2, G3, G4 и Р1А[8]).
Показания к применению
Активная иммунизация детей в возрасте от 6 до 32 недель с целью профилактики гастроэнтерита, вызываемого ротавирусами серотипов G1, G2, G3, G4 и серотипов G, содержащих Р1А[8] (например, G9).
Противопоказания
- Повышенная чувствительность к любому компоненту вакцины РотаТек®, а также на введение вакцины РотаТек® в анамнезе.
- Инвагинация кишечника в анамнезе.
- Врожденные пороки развития желудочно-кишечного тракта, предрасполагающие к инвагинации кишечника.
- Иммунодефицит, подозрение на иммунодефицит (см. ОСОБЫЕ УКАЗАНИЯ И ПОБОЧНОЕ ДЕЙСТВИЕ).
- Острые инфекционные и неинфекционные заболевания, обострение хронических заболеваний являются временными противопоказаниями для проведения прививок. Плановые прививки проводят через 2–4 недели после выздоровления или в период реконвалесценции или ремиссии. При нетяжелых острых вирусных респираторных инфекциях, острых кишечных заболеваниях и других заболеваниях прививки проводятся сразу после нормализации температуры.
- Острая форма диареи или рвоты (в этих случаях вакцинацию проводят на стадии ремиссии).
- Непереносимость фруктозы, нарушение всасывания глюкозо-галактозного комплекса, недостаточность ферментов сахаразы и/или изомальтазы.
С осторожностью
- При активных заболеваниях желудочно-кишечного тракта, включая хроническую диарею (отсутствие клинических данных).
- При задержке развития (отсутствие клинических данных).
- При иммунокомпрометированном состоянии (например, в результате злокачественных новообразований или иммунодепрессивной терапии).
- При близком контакте с лицами с иммунодефицитом (например, с лицами со злокачественными новообразованиями или с лицами, получающими иммуносупрессивную терапию).
- При трансфузии крови или продуктов крови, включая иммуноглобулины, менее чем за 42 дня до намеченной вакцинации.
Применение при беременности и в период грудного вскармливания
Вакцина РотаТек® предназначена только для детей. Данных по применению вакцины при беременности и/или в период грудного вскармливания нет.
Особые группы пациентов
Дети
Вакцина РотаТек® обычно хорошо переносится и обладает высокой эффективностью по предотвращению ротавирусного гастроэнтерита при применении у детей в возрасте от 6 до 32 недель.
Эффективность и безопасность не были установлены у детей в возрасте младше 6 недель.
Способ применения и дозы
Способ введения
ТОЛЬКО ДЛЯ ПРИЕМА ВНУТРЬ. НЕ ДЛЯ ИНЪЕКЦИЙ!
Вакцина РотаТек® представляет собой готовую к применению жидкость.
Вакцина РотаТек® может вводиться вне зависимости от времени приема пищи или любой жидкости, включая грудное молоко.
Вакцину РотаТек® нельзя смешивать с другими растворами и вакцинами в одной емкости. Вакцину РотаТек® нельзя растворять или разводить. Не использовать, если обнаружены внешние повреждения тубы и/или содержимое тубы выглядит иначе, чем указано в разделе «ОПИСАНИЕ» данной инструкции.
Схема вакцинации
Курс вакцинации состоит из трех доз препарата РотаТек®.
Первая доза препарата РотаТек® вводится детям в возрасте от 6 до 12 недель.
Последующие дозы вводятся с интервалом между введениями от 4 до 10 недель.
Все три дозы рекомендуется ввести до достижения ребенком возраста 32 недель.
При введении неполной дозы (например, ребенок выплюнул или срыгнул часть дозы) не рекомендуется вводить дополнительную дозу, так как данный режим дозирования не изучался в клинических исследованиях. Оставшиеся дозы следует вводить согласно схеме вакцинации.
Недоношенные дети
Вакцину РотаТек® можно применять у недоношенных детей, родившихся при сроке беременности не менее 25 недель. Вакцину следует вводить таким детям не ранее чем через 6 недель после рождения.
Рекомендации по подготовке и проведению вакцинации препаратом РотаТек®:
 |
Выньте одну упаковку из холодильника, разорвите ее и достаньте пластиковую тубу. |
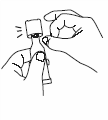 |
Держа тубу вертикально, колпачком кверху, постучите по колпачку, чтобы удалить жидкость из дозирующего наконечника. |
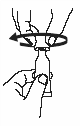 |
Откройте тубу двумя простыми движениями:
1. Проколите дозирующий наконечник, повернув завинчивающийся колпачок до упора по часовой стрелке. |
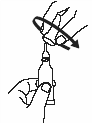 |
2. Поверните колпачок против часовой стрелки и снимите его. |
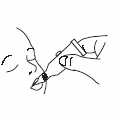 |
Введите дозу, осторожно выжимая жидкость в рот ребенка в направлении внутренней стороны щеки, пока туба не опустеет (в наконечнике тубы может остаться капля жидкости). |
| Пустые тубы и наконечник подлежат утилизации в контейнерах для биоотходов в соответствии с утвержденными правилами. |
Побочное действие
Вакцина обычно хорошо переносится.
У детей, участвовавших в трех плацебо-контролируемых клинических исследованиях (6130 детей в группе вакцины РотаТек®, 5560 детей в группе плацебо), были оценены побочные эффекты препарата РотаТек® в течение 42 дней после вакцинации с или без совместного использования других вакцин для детей. В целом нежелательные реакции были отмечены у 47% детей, получавших вакцину РотаТек®, по сравнению с 45,8% в группе плацебо. Наиболее частыми нежелательными явлениями были гипертермия (повышение температуры выше 38°С) (20,9%), диарея (17,6%) и рвота (10,1%).
Серьезные нежелательные реакции были оценены у всех участников (36150 детей в группе вакцины РотаТек®, 35536 детей в группе плацебо) в 3 клинических исследованиях в течение 42 дней после приема каждой дозы. В целом частота серьезных нежелательных реакций составляла 0,1% в группе вакцины РотаТек® и 0,2% в группе плацебо.
Нежелательные реакции в группе вакцины приведены ниже в соответствии с системой органов/классов. На основании объединенных данных 3 клинических исследований (6130 детей в группе вакцины РотаТек®, 5560 детей в группе плацебо) перечислены нежелательные реакции, частота которых в группе вакцины РотаТек® превосходила частоту в группе плацебо на 0,2–2,5%.
Нежелательные реакции, выделенные курсивом, наблюдались в пострегистрационном периоде.
Частота нежелательных реакций определялась следующим образом:
очень часто (≥1/10), часто (≥1/100, но <1/10), нечасто (≥1/1000, но <1/100), редко (≥1/10000, но <1/1000), очень редко (<1/10000), неизвестно (частоту данных нежелательных реакций невозможно установить из имеющихся данных).
— Инфекционные и паразитарные заболевания
Часто: инфекции верхних дыхательных путей
Нечасто: назофарингит, средний отит
— Нарушения со стороны иммунной системы
Неизвестно: анафилактическая реакция‡
— Нарушения со стороны дыхательной системы, органов грудной клетки и средостения
Редко: бронхоспазм
— Нарушения со стороны желудочно-кишечного тракта
Очень часто: диарея, рвота
Нечасто: гематохезия†, боль в верхних отделах живота
Редко: инвагинация кишечника†,*
— Нарушения со стороны кожи и подкожных тканей
Нечасто: сыпь
Редко: крапивница†
Неизвестно: ангиоэдема‡
— Общие расстройства и нарушения в месте введения
Очень часто: гипертермия
Неизвестно: раздражительность‡
† Данные нежелательные реакции были установлены в ходе пострегистрационного наблюдения. Частота данных нежелательных реакций оценивалась на основании соответствующих клинических исследований.
* см. ОСОБЫЕ УКАЗАНИЯ.
‡ Нежелательные реакции, которые наблюдались при пострегистрационном применении вакцины; их частоту невозможно установить из имеющихся данных.
Дополнительная информация по некоторым нежелательным реакциям
Болезнь Кавасаки наблюдалась у 5 из 36150 детей в группе вакцины (<0,1%) и 1 из 35536 в группе плацебо (<0,1%) с относительным риском 4,9 [95% ДИ: 0,6; 239,1] (статистически незначимо). Данные крупного пострегистрационного наблюдательного исследования безопасности не подтверждают повышения риска возникновения болезни Кавасаки после вакцинации препаратом РотаТек® (см. ИММУНОЛОГИЧЕСКИЕ СВОЙСТВА).
Инвагинация кишечника
Данные наблюдательных исследований безопасности, проведённых в нескольких странах, свидетельствуют о том, что применение вакцины для профилактики ротавирусной инфекции может увеличить риск возникновения инвагинации кишечника в течение 7 дней после вакцинации на 6 случаев на 100000 детей при сравнении с ожидаемым фоновым уровнем возникновения инвагинации. Существуют ограниченные данные, подтверждающие меньшее увеличение риска возникновения инвагинации кишечника после приема второй дозы. Фоновая частота случаев инвагинации кишечника у не вакцинированных ротавирусной вакциной детей младше 1 года в этих странах варьирует от 33 до 101 на 100000 детей в год. Неизвестно, связана ли регистрация более высокого числа случаев инвагинации кишечника с более длительным периодом наблюдения за детьми, которым вводили вакцину для профилактики ротавирусной инфекции (см. ОСОБЫЕ УКАЗАНИЯ).
Особые группы пациентов
Существует риск развития апноэ у недоношенных детей (рожденных на сроке беременности до 28 недель включительно) (см. ОСОБЫЕ УКАЗАНИЯ).
В ходе пострегистрационного наблюдения детей с тяжелым комбинированным иммунодефицитом были отмечены случаи гастроэнтерита, сопровождающегося выделением с калом штаммов ротавируса, входящих в состав вакцины.
Передозировка
Имеются сообщения о нескольких случаях передозировки вакциной РотаТек®. Отличий в профиле нежелательных явлений по сравнению с применением препарата в рекомендованных дозах нет.
Взаимодействие с другими лекарственными препаратами
Применение с другими вакцинами
Препарат РотаТек® можно вводить детям одновременно с любыми следующими антигенами, входящими в состав как моновалентных, так и комбинированных вакцин: дифтерийным анатоксином, столбнячным анатоксином, коклюшной вакциной, конъюгированной вакциной против Haemophilus influenzae тип b, инактивированной полиомиелитной вакциной, вакциной против вирусного гепатита B, гексавалентной вакциной (содержащей вышеперечисленные компоненты), конъюгированной пневмококковой вакциной, конъюгированной менингококковой вакциной серогруппы С. Не было отмечено снижения иммунного ответа при одновременном введении нескольких вакцин и вакцины РотаТек®.
Одновременное введение пероральной полиовакцины (ОПВ) и вакцины РотаТек® не влияло на иммунный ответ, вызываемый ОПВ, но несколько снижало иммунный ответ на вакцину РотаТек®, однако нет данных, подтверждающих снижение степени защиты от тяжелых форм ротавирусного гастроэнтерита. Иммунный ответ на вакцину РотаТек® не изменялся при введении ОПВ через две недели после введения вакцины РотаТек®.
Особые указания
Во время проведения вакцинации должны быть доступны все необходимые лекарственные препараты, включая адреналин (1:1000), на случай возникновения анафилактической реакции (см. ПОБОЧНОЕ ДЕЙСТВИЕ).
Данные по эффективности и безопасности применения вакцины РотаТек® у детей с компрометированным иммунитетом, детей с бессимптомной ВИЧ‑инфекцией или детей, которым было сделано переливание крови или введены иммуноглобулины не более чем за 42 дня до введения вакцины, отсутствуют. Маловероятно, что бессимптомная ВИЧ‑инфекция (ВИЧ‑носительство) будет влиять на безопасность и эффективность вакцины РотаТек®. Тем не менее в связи с недостаточностью клинических данных не рекомендуется назначение вакцины РотаТек® при бессимптомной ВИЧ‑инфекции.
У детей с тяжелым комбинированным иммунодефицитом были отмечены случаи гастроэнтерита, вызванного штаммами ротавируса, входящими в вакцину (см. ПРОТИВОПОКАЗАНИЯ).
По данным клинических исследований вакцинный вирус обнаруживался в кале у 8,9% вакцинированных детей только в течение 1 недели после введения первой дозы вакцины и только у 0,3% детей (1 случай) после введения 3‑ей дозы. Пик выделения вакцинного вируса приходится на 7‑й день после вакцинации. Согласно пострегистрационным данным возможна передача вакцинного вируса невакцинированным лицам. Вакцина РотаТек® должна с осторожностью назначаться детям, находящимся в тесном контакте с лицами с иммунодефицитом (в том числе, при контакте с лицами с онкологическими заболеваниями, иммунокомпрометированными или лицами, получающими иммуносупрессивную терапию). Следует соблюдать особые гигиенические правила при контакте с калом вакцинированного ребенка.
В клиническом исследовании вакцину РотаТек® применяли примерно у 1000 детей, рожденных при сроке гестации от 25 до 36 недель. Первую дозу вводили на 6‑ой неделе после рождения. Безопасность и эффективность вакцины РотаТек® была сопоставима у данной подгруппы детей и у подгруппы детей, родившихся в срок. Однако среди этих 1000 детей, 19 детей родилось в срок от 25 до 28 недель гестации, 55 – от 29 до 31 недель, а остальные – от 32 до 36 недель (см. ИММУНОЛОГИЧЕСКИЕ СВОЙСТВА И СПОСОБ ПРИМЕНЕНИЯ И ДОЗЫ).
Инвагинация
Поскольку данные наблюдательных исследований свидетельствуют о повышенном риске возникновения инвагинации кишечника после применения вакцины для профилактики ротавирусной инфекции в течение 7 дней после вакцинации (см. ПОБОЧНОЕ ДЕЙСТВИЕ), в качестве меры предосторожности врачу необходимо отслеживать любые симптомы, указывающие на возникновение этого заболевания (острая боль в животе, неукротимая рвота, наличие крови в кале, вздутие живота и/или высокая температура).
Родители/опекуны должны быть проинформированы о необходимости безотлагательно обращаться за медицинской помощью в случае возникновения таких симптомов.
В случае наличия предрасположенности к возникновению инвагинации кишечника см. раздел ПРОТИВОПОКАЗАНИЯ.
В настоящее время отсутствуют данные о безопасности и эффективности применения вакцины РотаТек® у новорожденных с желудочно-кишечными заболеваниями (включая хроническую диарею) и при задержке развития. Применение вакцины РотаТек® следует осуществлять с осторожностью у таких новорожденных, а также в том случае, когда, по мнению врача, отказ от вакцинации этой группы детей представляет больший риск, чем ее проведение.
Указанный уровень защиты после вакцинации препаратом РотаТек® обеспечивается при завершенном курсе вакцинации, состоящем из 3 доз. Как и любая другая вакцина, РотаТек® не может обеспечить полную защиту всех вакцинированных. Вакцина РотаТек® эффективна только против ротавирусной инфекции и не защищает от гастроэнтерита, вызванного другими патогенными микроорганизмами.
Клинические исследования эффективности защиты против ротавирусного гастроэнтерита проводились в Европе, США, странах Латинской Америки и Азии. Во время проведения данных клинических исследований наиболее распространенным генотипом ротавируса был G1P[8], в то время как остальные генотипы G2P[4], G3P[8], G4P[8] и G9P[8] обнаруживались реже. Уровень защиты, который обеспечивает вакцина РотаТек® против ротавирусов других типов и в других популяциях, неизвестен.
Данные клинических исследований по применению вакцины РотаТек® для профилактики после контакта с пациентом с ротавирусным гастроэнтеритом отсутствуют.
При решении о вакцинации ребенка с тяжелой степенью недоношенности (беременность ≤28 недель, но не менее 25 недель), особенно имеющего в анамнезе незрелость органов дыхания, необходимо учитывать тот факт, что польза иммунизации против ротавирусной инфекции у данной группы пациентов высока. Вследствие этого не следует ни отказываться от вакцинации, ни переносить ее сроки. Однако учитывая потенциальный риск апноэ, первую вакцинацию недоношенного младенца предпочтительно проводить в условиях стационара с возможностью врачебного наблюдения за состоянием такого пациента в течение 48–72 ч.
ВАКЦИНУ РотаТек® ЗАПРЕЩЕНО ВВОДИТЬ ИНЪЕКЦИОННО!
Вакцину РотаТек® следует вводить как можно быстрее после извлечения из холодильника.
В случае если вакцину не использовали, она подлежит утилизации в контейнерах для биоотходов в соответствии с утвержденными правилами.
Влияние на способность управлять транспортными средствами и работать с механизмами
Неприменимо.
Форма выпуска
Раствор для приема внутрь.
В тубе содержится одна прививочная доза.
По 2 мл в тубы из полиэтилена низкой плотности с отвинчивающейся крышкой из полиэтилена высокой плотности.
На корпусе тубы на английском языке нанесено: с одной стороны – «Rotavirus», «Vaccine» и логотип фирмы в виде графического символа, с другой – «Rotavirus», «Vaccine» и логотип фирмы в виде аббревиатуры «MSD».
Туба помещена в индивидуальную упаковку из фольги алюминиевой.
Упаковка для отпуска из аптек
По 1 тубе в упаковке из фольги алюминиевой вместе с инструкцией по применению в картонной пачке. Может присутствовать контроль вскрытия упаковки.
Упаковка для лечебно-профилактических учреждений
По 10 туб, каждая в индивидуальной упаковке из фольги алюминиевой, вместе с инструкцией по применению в картонной пачке. Может присутствовать контроль вскрытия упаковки.
Условия хранения
Хранить при температуре от 2 до 8°С в защищенном от света месте.
Хранить в недоступном для детей месте.
Срок годности
2 года. Не использовать после истечения срока годности, указанного на упаковке.
Условия отпуска
Упаковка с 1 тубой – «Отпускают по рецепту».
Упаковка с 10 тубами – «Для лечебно-профилактических учреждений».
Юридическое лицо, на имя которого выдано регистрационное удостоверение
ООО «МСД Фармасьютикалс», Россия
Производитель
Произведено:
Мерк Шарп и Доум ЛЛС, США
Merck Sharp & Dohme LLC, 770 Sumneytown Pike, West Point, PA 19486, USA
Выпускающий контроль качества:
Мерк Шарп и Доум Б.В., Нидерланды
Merck Sharp & Dohme B.V., Waarderweg 39, 2031 BN Haarlem, the Netherlands
или
Мерк Шарп и Доум ЛЛС, США
Merck Sharp & Dohme LLC, 770 Sumneytown Pike, West Point, PA 19486, USA
Претензии потребителей направлять по адресу
ООО «МСД Фармасьютикалс»
ул. Тимура Фрунзе, д. 11, стр. 1,
г. Москва, Россия, 119021
тел.: (495) 916-71-00;
факс: (495) 916-70-94
RU-NON-01045-02-23

